Contexte. Les protéines à centre fer-soufre (Fe-S) jouent un rôle central dans les plastes où elles participent notamment au transfert d’électrons dans la chaine photosynthétique, à l’assimilation du soufre et de l’azote, au métabolisme de la chlorophylle ou bien encore à la biosynthèse des vitamines ou des acides aminés. Leur maturation repose sur la machinerie d’assemblage SUF. Les centres Fe-S sont synthétisés de novo sur un complexe de protéines d’échafaudage, puis délivrés aux protéines clientes via plusieurs protéines de transfert. Cependant, les voies de maturation de la plupart des protéines clientes et leurs spécificités pour les protéines de transfert sont pour la plupart inconnues.
Questions. Identifier les protéines cibles de la protéine de transfert NFU2 et définir sa spécificité par rapport aux deux autres protéines NFU qui sont présentent dans les plastes (i.e. NFU1 et NFU3).
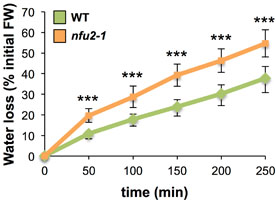
Résultats. En combinant protéomique quantitative et interactomique avec des analyses d’interaction in vivo (double hybride), nous avons identifié 14 nouvelles cibles de NFU2, parmi lesquelles neuf ont été validées in planta (BiFC). Ces analyses ont également révélé un rôle potentiel pour NFU2 dans la réponse des plantes à la dessiccation. Dans l’ensemble, cette étude a permis de mieux définir les mécanismes de maturation de plusieurs protéines chloroplastiques à centre Fe-S, augmentant ainsi considérablement le nombre de protéines à centre Fe-S ciblées par NFU2. Ces travaux ont également permis de clarifier les rôles respectifs des trois paralogues : NFU1, NFU2 et NFU3.
Berger N, Vignols F, Przybyla-Toscano J, Roland M, Rofidal V, Touraine B, Zienkiewicz K, Couturier J, Feussner I, Santoni V, Rouhier N, Gaymard F, Dubos C✉ (2020) Identification of client iron-sulfur proteins of the chloroplastic NFU2 transfer protein in Arabidopsis thaliana. J. Exp. Bot., 71(14):4171-4187
